手机电池为何越用越不耐用
小编在摸鱼把玩手机时
发现小编的手机电量转瞬即逝
这让我不得不感慨一声
转身寻找充电器了

为什么我们的手机越来越不经用呢?
这还得从我们的电池说起。
01、手机电池的早期产品
1973 年,世界上第一部手机在摩托罗拉实验室诞生 [1]。这一款手机非常笨重,但是得益于手机内置的镍镉电池,这部手机能够脱离繁杂的电子线路,实现实时的移动通话。
镍镉电池作为第一个内置在手机的电池,本身较为笨重。在上个世纪流行的“大哥大电话”,大多采用镍镉电池。镍镉电池的容量低,而且含有毒害性较强的镉,不利于生态环境的保护。并且镍镉电池还具有非常明显的记忆效应:在充电前如果电量没有被完全放尽,久而久之将会引起电池容量的降低。
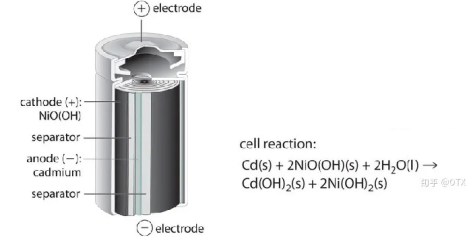
镍镉电池的基本结构 [2]
1990 年,日本索尼公司最早研发出镍氢电池。相比于它的老前辈,镍氢电池不仅能够做的更加轻薄、容量也得到有效提升 [3]。镍氢电池的出现使手机变得更为便携,手机也能够支撑更长时间的通话。因此,随着镍氢电池的出现,笨重的镍镉电池被逐步取代,小巧的移动手机得以流行。但是镍氢电池仍然存在记忆效应,这也是上一代的手机需要完全放电后再充电的原因。并且,由于镍镉电池的能量密度有限,因此当时的手机只能支持拨打电话等较为简单的任务,离现在我们的智能手机形态还有较大的差距。
02、锂电池的崛起
金属锂于十九世纪被发现。由于锂具有相对较低的密度、较高的容量以及相对较低的电势,因此作为原电池有得天独厚的优势。但是,锂是非常活泼的碱金属元素,导致金属锂的保存、使用或是加工对环境要求非常高,并且都比其他金属要复杂得多。因此,在研究以锂作为电极材料的锂电池的过程中,科学家们通过对锂电池不断发展、改进,克服了诸多研究难题,经过了很多阶段,才最终让它成为如今的模样。
采用金属锂作为负极的锂电池首先实现了商业化。1970 年日本松下公司发明了氟碳化物锂电池,这类电池的理论容量大,并且放电功率稳定,自放电现象小。但是这类电池无法进行充电,属于一次锂电池 [2]。
20 世纪 70 年代,来自埃克森美孚公司 (ExxonMobil) 的研发人员斯坦利・惠廷厄姆 (M. Stanley Whittingham) 提出了离子插层的电池充放电原理,并在 1975 年发表了二硫化钛锂电池的专利。在 1977 年,供职于埃克森公司的惠廷厄姆团队开发出了以铝锂合金 Li-Al 为负极、二硫化钛 TiS₂为正极的二次电池,其中铝锂合金可以提高金属锂的稳定性增强电池的安全性 [2]。在放电过程中,电池发生的电化学过程为:
负极:Li - e- → Li+
正极:xLi+ + TiS₂+ xe- → LixTiS₂
其中 TiS₂为层状化合物,层与层之间为相互作用较弱的范德华力(Van der Waals Force),体积较小的锂离子能够进入 TiS₂的层间并发生电荷转移,并贮存锂离子,类似于将果酱挤入三明治中,这个过程为离子的插层 [4][5]。在放电过程中,正极的 TiS₂层间插入电解液中的 Li+ 离子,接受电荷并形成 LixTiS₂。

TiS₂的结构以及放电过程中发生插层反应的原理 [6]
这一阶段的二次锂电池主要都采用了金属锂作为负极材料,通过改进正极材料提高电池的寿命和安全性。作为最早实现商业化的二次锂电池,采用金属锂作为负极材料具有较低的负极电势,电池的能量密度高,并且较为便携,但是它的安全性也受到了广泛的质疑。1989 年春末加拿大公司 Moli Energy 生产的第一代金属锂电池发生了爆炸事件, 这也使得金属锂电池的商业化一度陷入了停滞 [2]。
为了提升锂电池的安全性,研发新型电极材料对锂电池非常重要。但是,使用其他锂的化合物作为负极代替锂,会提升负极电势,降低锂电池的能量密度,使电池容量降低。因此,寻找合适的新型电极材料也成为锂电池研究领域的一道难题。
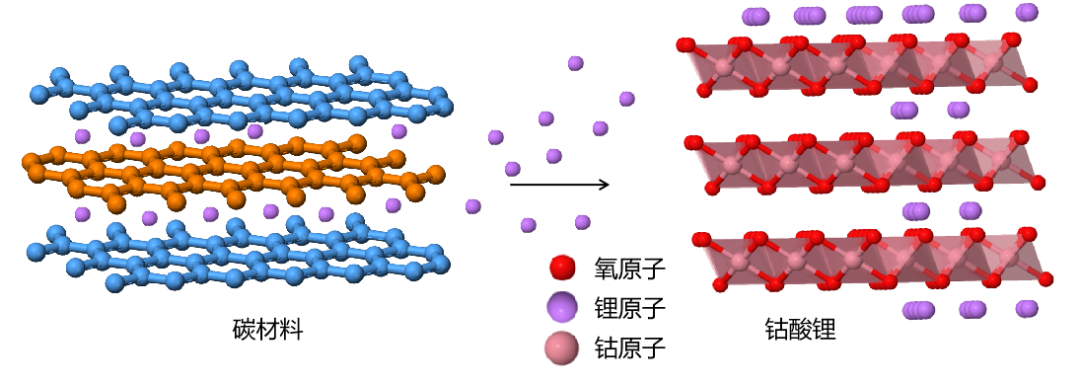
1980 年前后,任教于英国牛津大学的约翰・班尼斯特・古迪纳夫 (John Bannister Goodenough) 等人发现了能够容纳锂离子的化合物钴酸锂 LiCoO₂(LCO)。LiCoO₂相比于当时其他各类正极材料都具有更高的电势。这使得采用 LiCoO₂作为正极的锂电池能够提供更高电压,具有更高的电池容量。[7][8]

钴酸锂晶体结构示意图 [9]
钴酸锂晶体为层状结构,属于六方晶系。其中,O 与 Co 原子构成的八面体格子在平面上排列成 CoO₂层,并且 CoO₂层之间被锂离子相互间隔,并形成一个平面状的锂离子传输通道。这使钴酸锂能够通过平面状的锂离子通道较快地传输锂离子。锂离子在钴酸锂中的脱离与嵌入过程类似一个插层过程。在轻度充放电过程中,钴酸锂能够保持晶体结构的稳定。但是随着锂离子的逐渐脱出,钴酸锂具有向单斜晶系转变的倾向 [2]。以钴酸锂作为正极的锂电池中,在放电过程中,正极发生的反应为:
正极:Li1-xCoO₂ + xLi+ + xe- → LiCoO₂

放电过程钴酸锂中锂离子脱出示意图 [9]
相比于二硫化钛,钴酸锂正极材料具有较高的正极电势,同时层状结构钴酸锂能够较快地传输锂离子,是一种优良的锂离子电池正极材料。
就在同一年,拉奇德・雅扎米 (Rachid Yazami) 发现了锂离子在石墨中的可循环的离子插层现象,并验证了石墨作为锂电池正极的可行性 [10]。石墨具有层片状结构,并且与 TiS₂类似,石墨中层与层之间由微弱的范德华力连接,这使得体积较小的锂离子能够进入石墨层间并发生电荷转移。
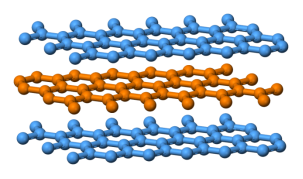
石墨具有层状结构,层与层之间由范德华力相互连接 [11]
在 1983 年的论文中 [12],雅扎米采用聚环氧乙烷-高氯酸锂固态电解,并且以金属锂为负极,石墨为正极组成原电池。在放电过程中,作为正极的石墨发生了如下反应:
nC + e- + Li+ → (nC, Li)
随后发生:(nC, Li) → LiCn
在石墨作为正极的原电池放电过程中,锂离子在石墨层中发生插层反应,发生电荷转移并形成化合物 LiCn。
03、锂离子电池的到来
1982 年,就职于日本旭化成公司的 (Asahi Kasei Corporation) 吉野・彰 (Yoshino Akira) 采用钴酸锂作为正极,聚乙炔 (C2H2)n 作为负极构建了锂离子电池的样品 [13]。在钴酸锂电池的放电过程中,锂离子从电池正极通过电解液迁移至钴酸锂中,实现电池放电。
但是,钴酸锂电池仍然存在许多问题。电池的负极聚乙炔的能量密度低,并且稳定性也较低。因此,吉野・彰采用了一种新型类石墨材料 "soft carbon" 代替聚乙炔作为电池的负极材料,并且在 1985 年制备了第一块锂离子电池原型,并申请了专利 [10]。由吉野・彰设计的锂离子电池原型成为许多现代电池的雏形。
锂离子电池放电,锂离子迁移过程示意图
与锂电池相比,吉野・彰设计的以碳质材料为负极,钴酸锂为正极的原电池摆脱了金属锂,因此这一类电池也被称为“锂离子电池”。由于钴酸锂锂离子电池中,锂离子在正负极都发生插层反应,通过锂离子的快速插层实现电荷的快速转移,因此这一电池结构也被形象地称为摇椅电池。
2019 年,诺贝尔化学奖颁发给了美国籍科学家约翰・B・古迪纳夫 (John B. Goodenough)、英国籍科学家斯坦利・惠廷厄姆 (M. Stanley Whittingham) 和日本籍科学家吉野・彰 (Akira Yoshino),以表彰他们对锂离子电池方面的研究贡献 [4]。

诺贝尔奖获得者:从左到右依次为美国籍科学家约翰・B・古迪纳夫 (John B. Goodenough)、英国籍科学家斯坦利・惠廷厄姆 (M. Stanley Whittingham) 和日本籍科学家吉野彰 (Akira Yoshino) [4]
以碳材料为负极、钴酸锂为正极的锂离子电池的出现推动了锂离子电池的发展。随着科研人员对锂离子电池的研究逐渐深入,锂离子电池的正极材料发展出了三种体系:钴酸锂 (LCO),磷酸铁锂 (LFP) 以及三元镍钴锰 (NMC / NCM) 体系。其中,钴酸锂体系拥有相对更高的电池容量,在我们平常使用的手机、电脑等 3C 电子产品领域有着举足轻重的地位。磷酸铁锂体系和三元锂体系拥有更高的稳定性,因此在新能源汽车中拥有较为广泛的应用。[14]
锂离子电池的出现彻底改变了我们的生活方式。与镍镉电池和镍氢电池相比,锂离子电池的能量密度更高,相同电池容量的锂离子电池更为便携,能够支撑集成丰富功能的智能手机的高功耗。同时,大部分的锂离子电池没有记忆效应,不需要完全放电后再充电,因此锂离子电池能够实现随需随充。与锂电池相比,锂离子电池的充电速率显著提升。并且锂离子电池的充电速率快,极大地方便了我们的生活。因此,在手机、移动电脑、新能源汽车等应用场景中,锂离子电池凭借其优异的性能逐步代替了部分场景中的镍镉电池和镍氢电池。
04、为什么手机电池寿命越用越短?
镍镉电池的伤痛 —— 记忆效应
对于镍镉电池而言,烧结制备的镍镉电池的负极镉的晶粒较粗,当镍镉电池长期不彻底充电、放电,镉晶粒容易发生聚集,集合成块。此时,电池放电时形成次级放电平台。电池会以这一次级放电平台作为电池放电的终点,电池的容量变低,并且在以后的放电进程中电池将只记住这一低容量 [15]。这也是为什么旧一代采用镍镉电池的手机经常被建议需要完全放电后再进行充电的原因。但是随着镍镉电池与镍氢电池加工工艺的不断提升,记忆效应对电池容量的影响被不断降低,完全充放电对电池寿命的危害逐渐显现出来。

镍镉电池具有明显的记忆效应,而锂离子电池几乎没有记忆效应。并且由于锂离子电池的能量密度高于镍镉电池,因此在我们的手机、电脑等一种产品中主要还是采用锂离子电池。所以,我们日常使用装载锂离子电池的智能手机或电脑的时候,不需要担心电池的记忆效应。
锂离子电池过度充放电导致寿命衰减
钴酸锂拥有较高的理论电容量,但是我们在使用过程中钴酸锂的实际容量远达不到理论容量。因为我们在对锂离子电池进行超过了这个容量后的充放电后,钴酸锂就会发生不可逆充放电过程,也就是我们常说的电池过充电或过放电。这个过程中伴随了钴酸锂的结构相变,使电池的容量降低。
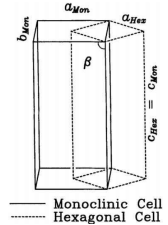
钴酸锂六方向单斜相转变的示意图 [16]
当电池发生过充电时,锂离子电池负极钴酸锂脱出大量锂离子,剩下的锂离子不足以支撑起钴酸锂原本的结构,导致 Li1-xCoO₂晶体由六方晶系向单斜晶系转变,原本的六方结构缺少离子支撑而崩塌。在这个过程中,钴酸锂相变并非完全可逆,钴酸锂的晶胞参数发生变化、应力变化、锂离子空位被压缩导致锂离子电池容量衰减。[17][18]
高电压锂离子电池的不稳定性
除了钴酸锂发生结构相变导致电池容量的不可逆变化,锂离子电池输出电压的提高也导致了锂离子电池中易发生其他副反应,锂离子电池寿命衰减。目前,市场上的智能手机通常采用的是 4.4V 左右的充放电电压 [14]。高电压能够提高锂离子电池的容量,加快锂离子电池的充放电速率。但是随之而来的就是锂离子电池电极表面的副反应的增大,电解液在高电压下的不稳定等一系列副作用。
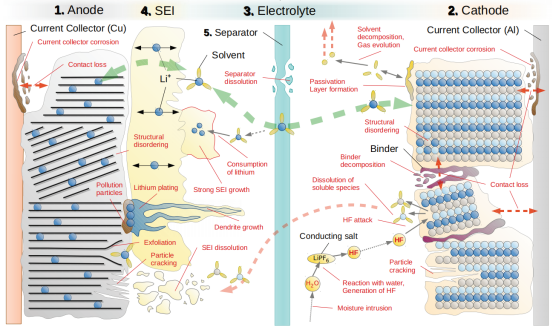
高电压锂离子电池的寿命衰减的影响机制 [18]
锂离子电池电解液在与正负极的固液相界面上发生反应,形成一层覆盖于电极表面的钝化层。这种钝化层具有固体电解质的特征,Li 离子可以经过该钝化层自由地嵌入和脱出,因此这层钝化膜被称为“固体电解质界面膜”(solid electrolyte interface),简称 SEI 膜 [19]。形成 SEI 膜的过程会消耗部分锂离子,使锂离子电池容量发生不可逆损耗。在高电压的作用下,这类电极表面的副反应严重,使电池容量逐渐下降。
05、使用手机时需要注意什么
高温不充电
在平时遇到手机过热或者温度极低的情况下,不要对手机充电。当手机过热时,在高温条件下给锂离子电池充电,也会使锂离子电池的正负极结构改变,从而导致电池容量不可逆的衰减。因此,尽量避免在过冷或过热条件下给手机充电,也能够有效延长其使用寿命。

及时更换电池
在我们使用手机、笔记本电脑或是平板电脑等数码产品的过程中,发现电池后盖发生变形、电池出现鼓包等异常情况时,要及时停止使用并向生产厂商更换电池,尽可能避免因电池使用不当留下的安全隐患。
参考文献
[1] 马丁・库帕_百度百科
https://baike.baidu.com/item/%E9%A9%AC%E4%B8%81%C2%B7%E5%BA%93%E5%B8%95/3066905?fr=ge_ala
[2] 锂电池的发展历史 知乎 https://zhuanlan.zhihu.com/ p/146768161
[3] 镍氢(MH-Ni)电池-知乎 https://zhuanlan.zhihu.com/ p/630028868
[4] The Nobel Prize in Chemistry 2019. NobelPrize.org. Nobel Prize Outreach AB 2023. Sun. 13 Aug 2023.
[5]Binghamton professor recognized for energy research https://www.rfsuny.org/rf-news/binghamton-energy/binghamton---energy.html
[6] Hongwei,Tao,Min,et al.TiS2 as an Advanced Conversion Electrode for Sodium-Ion Batteries with Ultra-High Capacity and Long-Cycle Life.[J].Advanced Science, 2018.
[7] Lithium-ion battery 维基百科 https://en.wikipedia.org/ wiki / Lithium-ion_battery
[8] John B. Goodenough Facts https://www.nobelprize.org/prizes/chemistry/2019/goodenough/facts/
[9] Lithium Cobalt Oxide – LiCoO2,https://www.chemtube3d.com/lib_lco-2/
[10] Lithium-ion battery 维基百科 https://en.wikipedia.org/ wiki / Lithium-ion_battery#cite_note-31
[11] Graphite 维基百科 https://en.wikipedia.org/ wiki / Graphite
[12] Yazami R, Touzain P. A reversible graphite-lithium negative electrode for electrochemical generators[J]. Journal of Power Sources, 1983, 9(3): 365-371.
[13] Akira Yoshino 维基百科 https://en.wikipedia.org/ wiki / Akira_Yoshino
[14] 当代锂离子电池体系简介 知乎 https://zhuanlan.zhihu.com/ p/374494628
[15] 记忆效应 百度百科 https://baike.baidu.com/ item/% E8% AE% B0% E5% BF%86% E6%95%88% E5% BA%94/1685065?fr=ge_ala
[16] Reimers J N , Dahn J R .Electrochemical and Insitu X-Ray-Diffraction Studies of Lithium Intercalation in Lixcoo2[J].Journal of the Electrochemical Society, 1992, 139(8):2091-2097.
[17] 钴酸锂作为锂离子正极材料研究进展 https://www.chemicalbook.com/ NewsInfo_21664.htm
[18] 张杰男.高电压钴酸锂的失效分析与改性研究 [D]. 中国科学院大学,2018.
[18] Schlasza C , Ostertag P , Chrenko D ,et al.Review on the aging mechanisms in Li-ion batteries for electric vehicles based on the FMEA method [C] 2014 IEEE Transportation Electrification Conference and Expo (ITEC).IEEE, 2014
[19] 锂电-锂离子电池中为什么会生成 SEI 膜?SEI 膜生成的具体步骤是什么?SEI 膜是什么样的结构?知乎 https://www.zhihu.com/ tardis / bd / art / 603133202?source_id=1001

加入微信
获取电子行业最新资讯
搜索微信公众号:EEPW
或用微信扫描左侧二维码